En este trabajo se presentan los resultados sobre un estudio preliminar de la calidad microbiológica del agua de abastecimiento en granjas de conejos en el noreste de Portugal. Los resultados de los análisis de 12 muestras de agua de granjas fueron negativos para la presencia de coliformes totales, coliformes fecales (Escherichia coli) y estreptococos fecales […]
En este trabajo se presentan los resultados sobre un estudio preliminar de la calidad microbiológica del agua de abastecimiento en granjas de conejos en el noreste de Portugal. Los resultados de los análisis de 12 muestras de agua de granjas fueron negativos para la presencia de coliformes totales, coliformes fecales (Escherichia coli) y estreptococos fecales (Enterococcus spp.).
En todas las muestras, el número total de microorganismos, a 22ºC, fue menos de 100 UFC/ml y a 37ºC fue de menos de 10 UFC/ml. Los resultados de este estudio mostraron una buena calidad microbiológica del agua de las granjas en la muestra. Sin embargo, debe tomarse en consideración el reducido número de granjas y en trabajos futuros las muestras deben de ser también tomadas en el interior de la granja, del agua ofrecida a los conejos.
La calidad del agua de bebida de los conejos es un parámetro fundamental que influencia en la ingestión del alimento y en el comportamiento de los animales afectando sus parámetros productivos y su bienestar.
La calidad microbiológica del agua de consumo viene contrastada a través de indicadores y parámetros relacionados com la contaminación fecal. Por agua potable se entiende toda aquella agua que no está contaminada por desechos humanos o animales o por contacto con residuos agropecuarios, industriales o naturales. Es decir, que mantiene sus características higiénicas y no es un peligro para la salud animal o la salud pública. La capacidad del agua para transmitir los agentes etiológicos de las enfermedades infecciosas es conocido desde la antiguedad.
Los parámetros microbiológicos que determinan la calidad del agua se obtienen por la identificación y aislamiento de bacterias coliformes totales y fecales, enterococos fecales, Clostridiums perfringens y la presencia de microorganismos viables a 37ºC y a 22ºC. Todos estos controles sirven para descartar la posibilidad de contaminaciones fecales del agua y los controles del agua de bebida deben ser efectuados de forma periódica en la explotación cunícola.
El orígen y la calidad del agua suministrada a una granja puede varias com el tiempo y estación del año. En época de lluvias, se puede producir la lixiviación del suelo donde están los restos fecales y se arrastre por el flujo acuoso aumentando la turbidez y aumentar la probabilidad de transmisión de patógenos tales como coliformes fecales, lo que resulta en un cambio en el agua potable.
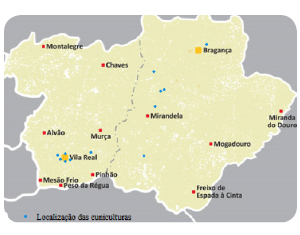
Figura 1. Localización de las granjas muestreadas
El objetivo de este estudio fue determinar la calidad microbiológica del agua potable de granjas cunícolas en la región Portuguesa de Trás-os-Montes.
Para ello se realizó durante los meses de marzo y abril del 2014 en la región Portuguesa de Trás-os-Montes y Alto Douro un estudio en el que se efectuaron 12 tomas de muestras en granjas cunícolas seleccionadas (Figura 1) investigándose en cada una de ellas el origen de la fuente de agua. Las muestras de agua de las explotaciones fueron recogidas en medios asépticos en recipientes esterilizados y mantenidas en temperatura estable en neveras com volúmenes aproximados de 2 L.
Cuando la muestra llegaba al laboratorio el agua era inmediatamente analizada a través de la técnica de membranas filtrantes utilizando un filtro com poros de diámetre de 0,45 μm. Para homogeneizar la muestra del agua se agitaba previamente. Posteriormente se sembraron en medios selectivos como Endo y Slanetz o PDA y se mantenían a 22ºC y 37ºC para su crecimiento.
Resultados
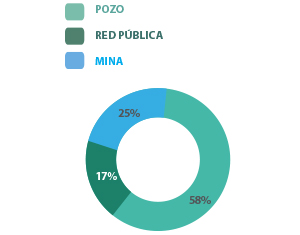
En el muestreo del agua de consumo se apreció que mayoritariamente (58%) provenían de pozos, el 25% de la red pública y el 17% de minas (Figura 2).
Figura 2. Orígen del agua suministrada a las explotaciones cunícolas.
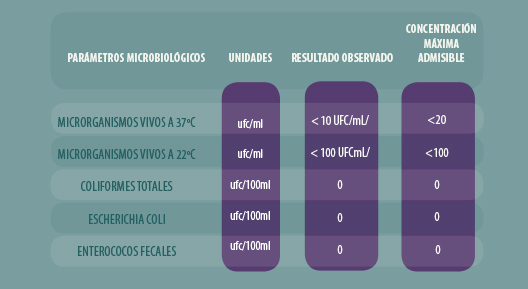
Los resultados obtenidos de los análisis microbiológicos del agua de consumo de los conejos fueron todos negativos de coliformes totales, coliformes fecales (Escherichia coli) y estreptococos fecales (Enterococcus spp.). Del mismo modo en todas las muestras el número total de microrganismos a 22ºC fue inferior a 100 UFC/mL y a 37ºC fueron menores de 10 UFC/mL. Unos resultados excelentes que permite decir que las aguas sumunistradas a las granjas son adecuadas para el consumo (Tabla 1).
En el control microbiológico del agua se supone que el aislamiento de microorganismos coliformes fecales tales como Escherichia coli indican una contaminación fecal relativamente reciente en el tiempo y en el espacio, como podría darse el caso en pozos con contaminaciones intermitentes. Los enterococos son indicadores por otro lado de contaminaciones fecales más remotas que Clostridium perfringens, que si se observan esporulados son indicadores de contaminaciones más antiguas y continuadas. Estos problemas de contaminación se resuelven con relativa facilidad mediante el uso de biocidas que eliminan los agentes indeseables del agua al adiciónarlos en el agua de bebida en cantidades moderadas y vigilando siempre no administrar en exceso
Tabla 1. Resultados de calidad microbiológica del agua en granjas cunícolas de la región Portuguesa de Trás-os-Montes y Alto Douro.
El resultado del presente estudio demuestra una situación muy favorable de la calidad delagua suministrada a las granjas cunícolas muestreadas. Con todo, puede darse facilmente que no haya relación entre la calidad del agua que beben los conejos y la suministrada por contaminaciones posteriores en los depósitos y tuberías del interior de la granja, debiendo también considerarse que el número de muestras y explotaciones es reducido,siendo por tanto necesario realizar estudios más completos de la calidad del agua suministrada dentro de las instalaciones para conocer la situación real de la calidad de agua que beben los animales.
Agradecimientos
El trabajo há sido apoyado por el proyecto de investigación estratégica PEst-OE/AGR/UI0772/2014 y financiado por la Fundação para a Ciência e Tecnologia (FCT). Agradecemos a los proprietarios de las explotaciones cunícolas y a los técnicos del Laboratório de microbiologia médica do Departamento de Ciências Veterinárias da UTAD por la colaboración en el trabajo.
Por Coelho A.C.1, Pinheiro V.2*
1 Dept. de Ciências Veterinárias, CECAV, Universidade de Trás-os-Montes e Alto Douro (UTAD), 5001-801 Vila Real, Portugal.
2 Dept. de Zootecnia, CECAV, Universidade de Trás-os-Montes e Alto Douro (UTAD), 5001-801 Vila Real, Portugal.